Amonium fluorida (Ammonium fluoride) merupakan senyawa yang memiliki rumus kimia NH4F.
senyawa ini memiliki rasa garam yang tajam, dan sangat mudah larut di dalam air. Seperti semua garam fluorida lainnya, zat ini cukup beracun baik pada overdosis akut maupun kronis.
 |
| Kristal ammonium fluorida (Gambar milik chemistrylearner com) |
1. Kegunaan atau Manfaat Amonium Fluorida
Ammonium fluorida, NH4F biasa disebut juga "amonium fluorida komersial (commercial ammonium fluorid)". Kata netral atau normal sering ditambahkan sehingga nama lainnya adalah ‘neutral ammonium fluorida atau normal ammonium fluorida’.
Perlu diperhatikan bahwa ammonium fluorida berbeda dengan ammonium bifluorida. Ammonium fluorida (NH4F) disebut sebagai garam netral, sedangkan ammonium bifluorida (NH4HF2) disebut sebagai garam asam.
Beberapa manfaat ammonium fluorida dalam kehidupan sehari-hari sebagai berikut.
- untuk mengukir di atas kaca
- untuk mengawetkan kayu
- sebagai agen anti mothproofing
- sebagai antiseptik di tempat pembuatan bir
2. Sifat Fisik atau Fisika Amonium Fluorida
Sifat fisika ammonium fluorida sebagai berikut.
- padatan kristal putih
- higroskopis (menyerap air)
- massa jenis (density) 1,009 g/cm3 pada suhu 25 °C
- titik lebur 100 °C (212 ° F; 373 K) (terurai)
- terurai saat dipanaskan
- sangat larut dalam air dingin (100 g/100 g pada suhu 0 °C)
- terurai dalam air panas
- sedikit larut dalam alkohol
- tidak larut dalam amonia cair
3. Pembuatan Amonium Fluorida
NH4F diproduksi dengan cara mengalirkan gas amonia melalui larutan asam fluorida encer 40% (berpendingin es).
Persamaan reaksinya :
NH3 + HF → NH4F
Sebagai alternatif, ammonium fluorida dapat dihasilkan dengan cara memanaskan amonium klorida dengan natrium fluorida berlebih. Amonium fluorida diperoleh dengan sublimasi.
Persamaan reaksinya :
NH4Cl + NaF → NH4F + NaCl
Selain kedua cara di atas, ammonium fluorida juga, dapat dibuat dengan cara mencampurkan amonia encer dengan amonium bifluorida, dalam jumlah yang sama.
4. Sifat Kimia atau Reaksi Kimia Amonium Fluorida
a. Pemanasan ammonium fluorida
Saat dipanaskan amonium fluorida akan menyublim. Ini merupakan sifat umum dari garam-garam amonium.
Dalam keadaan sublimasi, garam ammonium fluorida akan terurai menjadi amonia dan hidrogen fluorida. Dalam keadaan tertutup kedua gas tersebut dapat bergabung kembali menjadi amonium fluorida.
Persamaan reaksi kesetimbangan yang terjadi sebagai berikut.
NH4F ⇌ NH3 + HF
b. Reaksi ammonium fluorida dengan air
NH4F bereaksi dengan air, menghasilkan asam fluorida dan amonium hidroksida
Persamaan reaksinya :
NH4F + H2O → NH4OH + HF
c. Reaksi Amonium Fluorida dengan gas hidrogen fluorida
Saat melewatkan gas hidrogen fluorida (berlebih) melalui garam ammonium fluorida,maka amonium fluorida akan menyerap gas tersebut sehingga terbentuk senyawa tambahan amonium bifluorida.
Persamaan reaksinya
HF + NH4F → NH4HF2
d. Reaksi amonium fluorida dengan basa lemah
Larutan ammonium fluorida bersifat asam. Saat bereaksi dengan dengan basa lemah akan terbentuk garam ganda; yaitu, amonium heksafluoroaluminat, (NH4)3AlF6; amonium hexafluorophosphate, NH4PF6; amonium heksafluorosilikat, (NH4)2SiF6; amonium hexafluorogallate, (NH4)3GaF6:
Persamaan reaksinya :
6NH4F + Al(OH)3 → (NH4)3AlF6
+ 3NH3 + 3H2O
e. Reaksi Amonium Fluorida dengan Kalsium Nitrat
Amonium fluorida bereaksi dengan kalsium nitrat untuk membentuk kalsium fluorida, dinitrogen oksida, dan air.
Persamaan reaksinya :
Ca(NO3)2 + 2NH4F → CaF2 + 2N2O + 4H2O
f. Reaksi Amonium Fluorida dengan iodium
Ketika amonium fluorida dan iodium digunakan sebagai reaktan, maka dapat terjadi reaksi perpindahan tunggal (single displacement reaction) membentuk amonium iodida dan fluor.
Persamaan reaksinya :
NH4F + I2 → NH4I2 + F
5. Toksisitas
Ammonium fluorida NH4F merupakan zat kimia yang sangat beracun. Menelan NH4F dalam jumlah sedikit dapat menyebabkan mual, muntah, sakit perut, tremor, perdarahan, kelemahan otot, kejang dan kolaps pembuluh darah.
Menelan NH4F dalam jumlah banyak bisa menyebabkan kematian. Efek kronis termasuk bintik-bintik pada email, osteoklerosis dan kalsifikasi pada ligamen.
6. Struktur Kristal Amonium fluorida
Struktur kristal ammonium fluorida adalah Hexagonal wurtzite, seperti yang ditunjukan pada gambar di bawah ini.
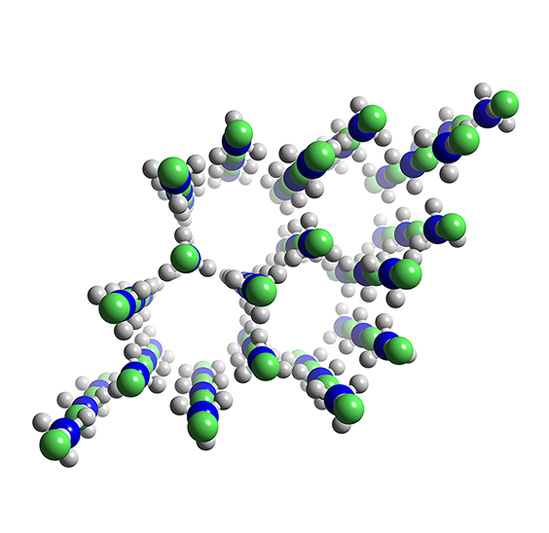 |
| (Gambar milik chemistrylearner com) |
Unitr sel struktur wurtzite, ditunjukan pada gambar di bawah ini.
SUMBER RUJUKAN
- Pradyot Patnaik, Ph.D. 2001. Handbook of Inorganic Chemicals. McGraw-Hill. ISBN 0-07-049439-8.
- Wikipedia. Ammonium Fluoride. Diakses pada Senin, 29 Maret 2021.
- Chemistrylearner com. Ammonium Fluoride. Diakses pada Senin, 29 Maret 2021.
Senyawa Amonium Lainnya:
- Amonium DihidrogenFosfat atau Monoamonium Fosfat

Tidak ada komentar:
Posting Komentar