Dalam semua reaksi kimia selalu berlaku hukum kekekalan
massa. Oleh karena itu pada
persamaan reaksi diberikan koefisien tertentu dan koefisien tersebut menyatakan
mol atom yang terdapat pada reaktan dan produk. Berdasarkan hukum kekekalan
massa maka jumlah mol pada reaktan harus sama dengn jumlah mol yang terdapat
pada produk.
Reaksi-reaksi redoks yang sederhana dapat diselesaikan
dengan cepat tanpa diperlukan suatu langkah penyetaraan yang khusus, namun untuk reaksi yang cukup
kompleks penyetaraan diperlukan cara-cara khusus.
Terdapat dua
metoda khusus yang dapat digunakan untuk menyetarakan reaksi redoks yaitu:
A. Metoda bilangan oksidasi
B. Metoda stengah reaksi.
A. METODA BILANGAN OKSIDASI (OXIDATION
NUMBER METHOD)
Penyetaraan reaksi dengan metode bilangan oksidasi
didasarkan pada perubahan bilangan oksidasi dari spesi yang mengalami oksidasi
atau reduksi. Berikut beberapa hal yang perlu diperhatikan dalam menyetarakan
reaksi redoks dengan metode bilangan oksidasi.
- Jumlah bilangan oksidasi unsur yang dioksidasi harus sama dengan
jumlah berkurangnya bilangan oksidasi unsur yang direduksi.
- Jumlah (aljabar) muatan ion pada reaktan dan produk harus sama.
Tetapi terkadang ion-ion yang tidak mengalami perubahan bilangan oksidasi tidak
ditulis.
- Suasana berlangsungnya reaksi, asam atau basa.
Berikut tahap-tahap penyetaran reaksi redoks beserta
aplikasinya pada penyetaraan reaksi redoks yang berlangsung dalam suasana asam dan basa.
MENYETARAKAN REAKSI
REDOKS DALAM SUASANA ASAM
Contoh Soal 1
Tulislah langkah-langkah yang diperlukan untuk menyetarakan
reaksi berikut ini.
MnO4- + Cl- ⟶ Mn2+ + Cl2
Penyelesaian
Tahap 1: Identifikasi unsur-unsur yang mengalami perubahan bilangan
oksidasi pada reaktan dan produk.
Tahap 2: Setarakan jumlah atom, unsur yang mengalami perubahan
bilangan oksidasi diruas kiri dengan ruas kanan dengan memberi koefisien yang
sesuai.
Tahap 3: Hitung jumlah bertambah dan berkurangnya bilangan oksidasi.
Tahap 4: Setarakan jumlah bertambah dan berkurangnya bilangan
oksidasi. Pada tahap ini jumlah
berkurang bilangan oksidasi Mn menjadi Mn2+ (tahap 3) dikali dengan
koefisien Cl- dan Cl2, begitupun sebaliknya jumlah
bertambahnya bilangan oksidasi Cl- menjadi Cl2 dikali
dengan koefisien MnO4 dan Mn2+.
Tahap 5: Setarakan jumlah muatan di ruas kiri dan kanan dengan
menambah ion H+ pada sisi yang lebih negatif. Ditambah ion H+
karena reaksi berlangsung dalam suasana asam.
Tahap 6: Setarakan jumlah atom H di ruas kiri dan kanan dengan
menambah H2O pada pada ruas yang kekurangan atom H.
PEMBUKTIAN
* JUMLAH ATOM
Jenis atom
|
Di ruas kiri
|
Di ruas kanan
|
Mn
|
2 x 1 = 2
|
2 x 1 = 2
|
O
|
2 x 4 = 8
|
8 x 1 = 8
|
Cl
|
10 x 1 = 10
|
5 x 2 = 10
|
H
|
16 x 1 = 16
|
8 x 2 = 16
|
* JUMLAH MUATAN
- Muatan Positif
Di ruas kiri
|
Di ruas kanan
|
16 x (+1) = +16
|
2 x (+2) = +4
|
- Muatan Negatif
Di ruas kiri
|
Di ruas kanan
|
2 x (-1) = -2
10 x (-1) = -10
|
0
|
- JUMLAH MUATAN DI RUAS KIRI
(+16) + (-2) + (-10) = +4
- JUMLAH MUATAN DI RUAS KANAN
(+4) + 0 = +4
MENYETARAKAN REAKSI
REDOKS DALAM SUASANA BASA
Menyetarakan reaksi redoks yang berlangsung dalam suasana
basa pada dasarnya sama dengan tahap-tahap dalam suasana asam. Perbedaannya
terletak pada tahap 5 yakni untuk menyamakan jumlah muatan reaktan dan produk, dalam
suasana asam ditambah ion H+ sedangkan dalam suasana basa ditambah
ion OH-.
Berikut contoh menyetarakan reaksi redoks yang berlangsung
dalam suasan basa.
Contoh Soal 2
Tulislah langkah-langkah yang diperlukan untuk menyetarakan
reaksi berikut ini.
Al + NO3- ⟶ AlO2-
+ NH3
Penyelesaian
Tahap 1: Identifikasi unsur-unsur yang mengalami perubahan bilangan
oksidasi pada reaktan maupun produk.
Tahap 2: Samakan jumlah atom unsur yang mengalami perubahan bilangan
oksidasi di ruas kiri dan di
ruas kanan dengan memberi koefisien yang sesuai.
Tahap 3: Hitung jumlah bertambah dan berkurangnya bilangan oksidasi.
Tahap 4: Samakan jumlah bertambah dan berkurangnya bilangan
oksidasi.
Tahap 5: Samakan jumlah muatan-muatan ion diruas kiri dan kanan
dengan menambah ion OH-, karena reaksi berlangsung dalam suasana
basa.
Tahap 6: Menambah H2O pada pada ruas yang kekurangan atom
H untuk menyetarakan jumlah atom H di ruas kiri dan kanan.
PEMBUKTIAN
JUMLAH ATOM
Jenis atom
|
Di ruas kiri
|
Di ruas kanan
|
Al
|
8 x 1 = 8
|
8 x 1 = 8
|
N
|
3 x 1 = 3
|
8 x 1 =
|
O
|
3 x 3 = 9
5 x 1 = 5
2 x 1 = 2
Jumlah semua = 16
|
8 x 2 = 16
|
H
|
5 x 1 = 5
2 x 2 = 4
|
3 x 3 = 9
|
JUMLAH MUATAN
Muatan di ruas kiri
|
Muatan di ruas kanan
|
3 x (-1) = -3
5 x (-1) = -5
Jumlah semua = (-3) + (-5)
= -8
|
8 x (-1) = 8
|
LATIHAN
SOAL
Setarakan
reaksi berikut menggunakan metode bilangan oksidasi: (reaksi berlangsung dalam
suasana asam)
1. Al(s)
+ H2SO4(aq) ⟶ Al2(SO4)3(aq) + H2(g)
2. KMnO4(aq) + Na2SO3(aq)
+ H2SO4(aq) ⟶ K2SO4(aq)
+ MnSO4(aq) + Na2SO4(aq) + H2O(l)
B. METODE SETENGAH REAKSI (HALF REACTION METHOD)
Tahap-tahap menyetarakan reaksi
redoks dengan metode setengah
reaksi atau metode ion elektron berbeda dengan metode bilangan oksidasi tetapi
memberikan hasil akhir yang sama. Berikut beberapa hal yang perlu diperhatikan
pada cara ini, yaitu:
- Persamaan reaksi redoks merupakan penjumlahan dua setengah
reaksi.
- Jumlah elektron yang dilepaskan pada oksidasi sama dengan jumlah
elektron yang ditangkap pada reaksi reduksi.
- Suasana berlangsungnya reaksi, asam atau basa.
MENYETARAKAN REAKSI
REDOKS DALAM SUASANA ASAM
Contoh Soal 3
Tulislah langkah-langkah yang diperlukan untuk menyetarakan
reaksi berikut yang berlangsung dalam suasana asam.
Penyelesaian
Tahap 1: Identifikasi unsur-unsur yang mengalami perubahan
bilangan oksidasi.
Dari bilangan oksidasi yang
telah dihitung dari masing-masing spesi diketahui biloks Cr turun dari +6
menjadi +3 sedangkan Cl bertambah dari -1 menjadi +1. Jadi dalam reaksi ini Cr
mengalami reduksi sedangkan Cl mengalami oksidasi.
Tahap 2: Menulis secara terpisah spesi yang mengalami osidasi dengan
spesi yang mengalami reduksi (setengah reaksi).
Tahap 3: Setarakan jumlah atom yang mengalami oksidasi dan reduksi
diruas kiri dan kanan dengan memberi koefisien yang sesuai.
Tahap 4: Setarakan jumlah atom O dengan menambahkan H2O
pada sisi yang kekurangan atom O.
Tahap 5: Setarakan jumlah atom H, dengan menambahkan ion H+
pada sisi yang kekurangan atom H.
Tahap 6: Setarakan jumlah muatan dengan menambahkan elektron pada
sisi setengah reaksi yang kelebihan muatan positif. Untuk reaksi oksidasi
elektron selalu ditambahkan ruas kanan sedangkan reaksi reduksi selalu ditambah
disebelah kiri.
Tahap 7: Gabungkan dua setengah reaksi kemudian menyamakan jumlah
elektron yang dilepaskan pada reaksi oksidasi dengan jumlah elektron yang
diterima pada reaksi reduksi. Bagian yang sama dapat dicoret.
MENYETARAKAN REAKSI
REDOKS DALAM SUASANA BASA
Untuk reaksi yang berlangsung dalam suasana basa tahap-tahap
penyetaraan seperti pada suasana asam, perbedaan terletak pada tahap akhir.
Misalnya setarakan reaksi berikut yang berlangsung dalam suasana basa:
Tahap 1: Mengidentifikasi unsur-unsur yang mengalami perubahan
bilangan oksidasi.
Tahap 2: Menulis secara terpisah spesi yang mengalami osidasi dengan
yang mengalami reduksi (setengah reaksi).
Tahap 3: Setarakan jumlah atom yang mengalami oksidasi dan reduksi
diruas kiri dan kanan dengan memberi koefisien yang sesuai.
Tahap 4: Setarakan
jumlah atom O dengan menambahkan H2O pada sisi yang kekurangan atom
O.
Tahap 5: Setarakan jumlah atom H, dengan menambahkan ion H+
pada sisi yang kekurangan atom H.
Tahap 6: Setarakan jumlah muatan dengan menambahkan elektron pada
sisi setengah reaksi yang kelebihan muatan positif atau kurang negatif. Untuk reaksi oksidasi
elektron selalu ditambahkan ruas kanan sedangkan reaksi reduksi selalu ditambah
disebelah kiri.
Tahap 7: Gabungkan dua setengah reaksi kemudian menyamakan jumlah
elektron yang dilepaskan pada reaksi oksidasi dengan jumlah elektron yang
diterima pada reaksi reduksi.
Karena reaksi berlangsung dalam suasana basa maka ion H+
yang ada harus dinetralkan. Hal ini dapat dilakukan dengan cara menambah ion OH-
pada kedua ruas dan ion OH- yang ditambahkan sama dengan jumlah ion
H+ yang ada.
Pada reaksi di atas terdapat 10 ion H+ maka
ditambahkan 10 ion OH-. Jadi persamaannya dapat ditulis sebagai:
10 ion H+ dan 10 OH- pada reaktan
(ruas kiri) dapat bergabung membentuk 10 molekul air.
10 molekul air yang terbentuk di kurangi 2 molekul air di
produk (ruas kanan) sehingga persamaan reaksinya menjadi:
LATIHAN
SOAL
Setarakan
reaksi-reaksi berikut ini dengan metode setengah reaksi.
1. SO32- + H+
MnO4- ⟶ SO42-
+ Mn2+ + H2O (suasana asam)
2. P4(s) + OH-(aq) +
H2O ⟶ H2PO2-(aq) + PH3(g) (suasana basa)







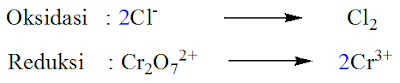











Tidak ada komentar:
Posting Komentar